
La troisième loi de la thermodynamique stipule que lorsqu'une substance refroidit jusqu'à une température proche du zéro absolu (-273,15°C ou 0 Kelvin), son entropie, qui est une mesure du désordre ou de l'incertitude dans le système, se rapproche d'une valeur constante et finie. valeur.
Cette loi postule qu’atteindre le zéro absolu nécessiterait un nombre infini d’étapes, ce qui le rendrait inaccessible en pratique. En outre, cela suggère que tous les systèmes atteindraient un état d’ordre maximum et de désordre théorique minimum à cette température extrême, ce qui aurait des implications fondamentales dans des domaines tels que la physique quantique et l’étude de nouveaux matériaux dotés de propriétés extraordinaires à des températures ultra-basses.
Voici quelques exemples qui illustrent ce principe :
Exemple 1 : Cristaux de glace
 Lorsque l'eau est refroidie à des températures très basses, proches du zéro absolu (0 K ou -273,15 °C), les molécules d'eau perdent de l'énergie cinétique et s'organisent en une structure cristalline très ordonnée, formant de la glace. Dans ces conditions, l’énergie thermique est si faible que les molécules vibrent à peine et adoptent une disposition fixe et régulière.
Lorsque l'eau est refroidie à des températures très basses, proches du zéro absolu (0 K ou -273,15 °C), les molécules d'eau perdent de l'énergie cinétique et s'organisent en une structure cristalline très ordonnée, formant de la glace. Dans ces conditions, l’énergie thermique est si faible que les molécules vibrent à peine et adoptent une disposition fixe et régulière.
À mesure que la température s'approche du zéro absolu, tout désordre thermique résiduel diminue et les cristaux de glace atteignent un état d'ordre maximum, où l'entropie est minime. Théoriquement, au zéro absolu, il n’y aurait aucun mouvement moléculaire et le système serait dans son état d’entropie le plus bas possible.
Exemple 2 : Supraconductivité
La supraconductivité est un phénomène physique qui se produit dans certains matériaux lorsqu'ils sont refroidis en dessous d'une température critique spécifique. À cette température critique, les matériaux supraconducteurs présentent une propriété unique : la résistance électrique disparaît complètement, permettant à l’électricité de circuler sans perte d’énergie.
La troisième loi de la thermodynamique explique la relation entre la supraconductivité et la réduction de l'entropie à des températures ultra-basses.
Dans des conditions normales, lorsque nous appliquons un courant électrique à travers un conducteur, tel qu'un fil de cuivre, les électrons qui transportent l'électricité se heurtent à des obstacles et à des collisions avec les ions du matériau, créant ainsi une résistance au flux d'électrons. Cette résistance est responsable de la perte d’énergie sous forme de chaleur et limite le rendement des appareils électriques.
Cependant, dans un matériau supraconducteur, à des températures très basses proches du zéro absolu, quelque chose d'étonnant se produit : les électrons forment des « paires de Cooper ». Ces paires sont constituées de deux électrons qui se lient et se déplacent ensemble à travers le cristal sans rencontrer de résistance.
Exemple 3 : Hélium liquide
 L'hélium est un gaz inerte à température ambiante, mais à des températures extrêmement basses, proches du zéro absolu, il présente un comportement fascinant et unique. Lorsqu’il est suffisamment refroidi, jusqu’à environ 4,2 K, l’hélium ne se solidifie pas comme les autres gaz, mais devient plutôt liquide.
L'hélium est un gaz inerte à température ambiante, mais à des températures extrêmement basses, proches du zéro absolu, il présente un comportement fascinant et unique. Lorsqu’il est suffisamment refroidi, jusqu’à environ 4,2 K, l’hélium ne se solidifie pas comme les autres gaz, mais devient plutôt liquide.
À mesure que l’hélium refroidit et se transforme en liquide, les atomes d’hélium perdent de l’énergie thermique, réduisant ainsi leur agitation et leur mobilité. Cette diminution de l’énergie cinétique des atomes se traduit par une réduction significative de l’entropie. À des températures encore plus basses, l’hélium présente des propriétés quantiques, telles que la superfluidité, où il s’écoule sans aucune friction.
À mesure que le système s’approche du zéro absolu, il se rapproche d’un état d’ordre presque parfait, où l’entropie tend vers son minimum.
Exemple 4 : condensats de Bose-Einstein
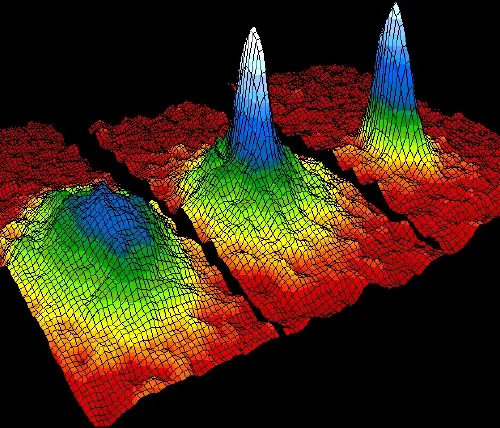 À des températures proches du zéro absolu, certains atomes se réunissent dans un état d’agrégation spécial appelé condensat de Bose-Einstein.
À des températures proches du zéro absolu, certains atomes se réunissent dans un état d’agrégation spécial appelé condensat de Bose-Einstein.
Dans cet état quantique, les atomes perdent leur individualité et se comportent comme une seule entité quantique. Ce phénomène est possible grâce à la troisième loi de la thermodynamique, qui stipule que l'entropie diminue à mesure que des températures extrêmement basses sont atteintes.
Ce phénomène a été prédit par Albert Einstein et le physicien indien Satyendra Nath Bose dans les années 1920. L'idée est basée sur les statistiques quantiques de Bose-Einstein, qui décrivent le comportement de particules identiques et indiscernables, comme les photons de lumière ou les atomes qui composent certaines particules. éléments.
Dans des conditions normales, à des températures plus élevées, les particules suivent une distribution statistique de Fermi-Dirac (pour les fermions) ou de Maxwell-Boltzmann (pour les bosons).
Cependant, lorsque les particules sont refroidies à des températures extrêmement basses, leur comportement quantique collectif commence à dominer et elles ont tendance à « s’effondrer » dans l’état d’énergie le plus bas possible. À ce stade, un grand nombre de particules occupent un seul état quantique, formant ce que l’on appelle le condensat de Bose-Einstein.
Dans cet état quantique, les particules perdent leur individualité et se comportent comme une « superparticule » collective, dotée de propriétés quantiques macroscopiques. La substance entière devient une seule entité quantique
Exemple 5 : Hélium solide
 À des températures proches du zéro absolu, l’hélium liquide peut également se solidifier. À l’état solide, l’hélium présente un comportement inhabituel, comme la superfluidité, où il peut s’écouler sans résistance à travers des capillaires extrêmement étroits, défiant ainsi les lois classiques de la physique.
À des températures proches du zéro absolu, l’hélium liquide peut également se solidifier. À l’état solide, l’hélium présente un comportement inhabituel, comme la superfluidité, où il peut s’écouler sans résistance à travers des capillaires extrêmement étroits, défiant ainsi les lois classiques de la physique.
Exemple 6 : Glace carbonique
 La neige carbonique est du dioxyde de carbone (CO₂) à l'état solide à des températures bien inférieures au point de congélation de l'eau. Contrairement à l'eau, qui gèle à 0°C, le CO₂ se solidifie directement en neige carbonique à une température de -78,5°C (-109,3°F) à pression atmosphérique normale.
La neige carbonique est du dioxyde de carbone (CO₂) à l'état solide à des températures bien inférieures au point de congélation de l'eau. Contrairement à l'eau, qui gèle à 0°C, le CO₂ se solidifie directement en neige carbonique à une température de -78,5°C (-109,3°F) à pression atmosphérique normale.
Lorsque la neige carbonique est à des températures proches du zéro absolu, elle se comporte de la même manière que les autres solides à ces températures extrêmement basses. Les molécules de CO₂ qui forment la neige carbonique réduisent considérablement leur énergie cinétique, ce qui entraîne une structure hautement ordonnée et une diminution significative de l'entropie. Dans cet état, la neige carbonique atteindrait sa disposition thermique maximale possible à température ambiante.
La glace carbonique est largement utilisée comme réfrigérant, dans l'industrie alimentaire, pour le transport de matériaux sensibles à la chaleur et comme effet spécial dans l'industrie du théâtre et du divertissement.