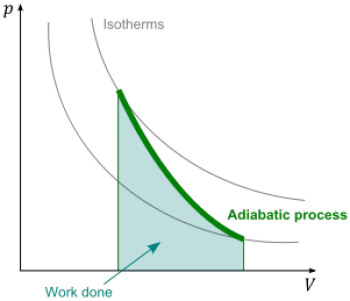
Une transformation (ou processus) adiabatique est un processus thermodynamique dans lequel un système n’échange pas de chaleur avec son environnement. Cela implique que la chaleur entrant ou sortant du système est nulle, c'est-à-dire que la variation de l'énergie interne du système est due uniquement au travail effectué sur lui ou par lui.
Le terme « adiabatique » fait référence aux éléments ou conditions qui empêchent l’échange de chaleur avec l’environnement, comme une paroi adiabatique qui ne permet pas le transfert de chaleur.
L’hypothèse selon laquelle un processus est adiabatique est souvent utilisée comme approximation simplificatrice dans de nombreuses analyses thermodynamiques, car elle facilite les calculs. Cependant, dans la pratique, les systèmes parfaitement adiabatiques n’existent pas, même s’ils peuvent être approchés dans de nombreux cas.
Le concept de transformation adiabatique est fondamental pour comprendre et appliquer la première loi de la thermodynamique, car il établit la relation entre la chaleur, le travail et l’énergie interne d’un système en l’absence de transfert de chaleur.
Exemples de transformations adiabatiques
Vous trouverez ci-dessous quelques exemples de processus adiabatiques dans différents systèmes thermodynamiques :
Détente et compression dans un cylindre avec du gaz
 Dans un moteur à combustion interne, le mélange air-carburant est comprimé de manière adiabatique lorsque le piston se déplace vers le haut dans le cylindre.
Dans un moteur à combustion interne, le mélange air-carburant est comprimé de manière adiabatique lorsque le piston se déplace vers le haut dans le cylindre.
Ce processus de compression augmente la température du gaz grâce à une compression rapide et sans perte de chaleur dans l'environnement. À la fin du cycle, lorsque le piston descend, le gaz se dilate de manière adiabatique, effectuant un travail sur le piston sans aucun échange de chaleur avec l'environnement.
Écoulement de gaz à travers une buse (buse de Laval)
Dans un moteur à réaction, les gaz d'échappement sont accélérés lorsqu'ils traversent une tuyère, provoquant une expansion adiabatique.
Au cours de cetransformation, le gaz se dilate rapidement, augmentant son volume et réduisant sa pression, sans échanger de chaleur avec l’environnement. L'énergie interne du gaz est convertie en énergie cinétique, permettant au gaz d'accélérer à des vitesses élevées, générant la poussée nécessaire pour propulser l'avion.
Descente de l'air dans l'atmosphère (chauffage adiabatique)
Lorsqu'une masse d'air descend dans l'atmosphère, comme cela se produit dans les phénomènes météorologiques tels que le foehn ou le chinook, l'air est comprimé de manière adiabatique.
Ce processus provoque une augmentation de la température de l’air sans aucun transfert de chaleur de l’environnement.
Ce type de réchauffement contribue à la formation de vents chauds qui affectent les régions montagneuses et à la prévision des phénomènes climatiques.
Réfrigérateurs et systèmes de climatisation
Dans un système de réfrigération, tel que la climatisation, le gaz réfrigérant subit une expansion adiabatique lorsqu'il traverse le détendeur.
Dans ce processus, la pression et la température du gaz diminuent rapidement sans échange de chaleur avec l’environnement.
Production sonore dans les gaz
Les ondes sonores se propagent dans l’air par des transformations adiabatiques. Au fur et à mesure que l’onde sonore se propage, les particules d’air sont rapidement comprimées et dilatées, sans laisser le temps à un échange de chaleur significatif de se produire.
Expansion d'un ballon d'hélium
Lorsque de l’hélium gazeux est libéré dans un ballon, le gaz se dilate de manière adiabatique. Si le ballon monte dans l'atmosphère, l'hélium se dilate sans échanger de chaleur avec l'environnement, car le processus est très rapide.
L'expansion adiabatique de l'hélium dans le ballon réduit sa pression et sa température, lui permettant de monter.
Compression d'air dans un compresseur d'air
Dans un compresseur d’air, l’air est comprimé de manière adiabatique lorsqu’il est introduit dans un volume plus petit. Cetransformation augmente la température de l’air sans permettre à la chaleur de se dissiper dans l’environnement, ce qui provoque un réchauffement considérable de l’air.
L'énergie utilisée pour comprimer l'air augmente son énergie interne, qui peut ensuite être utilisée dans des applications telles que l'alimentation d'outils pneumatiques ou dans les systèmes de réfrigération.
Piston dans un moteur Stirling
 Dans un moteur Stirling, le gaz à l'intérieur des cylindres se dilate de manière adiabatique pendant la phase de travail. Lorsque le gaz se dilate, un travail est effectué sur le piston, mais aucune chaleur n'est échangée avec l'environnement.
Dans un moteur Stirling, le gaz à l'intérieur des cylindres se dilate de manière adiabatique pendant la phase de travail. Lorsque le gaz se dilate, un travail est effectué sur le piston, mais aucune chaleur n'est échangée avec l'environnement.
Ce type de moteur tire parti des variations de température dans un cycle adiabatique pour générer efficacement de l'énergie, bien que des mécanismes supplémentaires soient nécessaires pour l'échange de chaleur dans d'autres phases du cycle.
Concepts connexes
-
Un processus isentropique est une transformation adiabatique qui est également réversible. Dans ce cas, le système maintient également une entropie constante, ce qui en fait un processus idéal pour diverses applications d’ingénierie.
-
Un mur adiabatique est un mur qui ne permet pas le transfert de chaleur entre le système et son environnement. En pratique, un mur isolé peut se rapprocher des conditions d’un mur adiabatique, mais pas parfaitement.
-
Un système adiabatique est un système dans lequel l’échange de chaleur avec l’extérieur n’est pas autorisé. Ce concept est essentiel dans la modélisation de divers processus thermodynamiques et est couramment utilisé en ingénierie et en physique.
Chauffage et refroidissement adiabatiques
La compression adiabatique d’un gaz provoque une augmentation de la température. Cela augmente également l’énergie interne du gaz. L'expansion adiabatique provoque une baisse de température.
Dans les deux processus, l’énergie du système reste constante. Il n’y a aucun gain ou perte de chaleur. En revanche, la détente libre est une transformation isotherme pour un gaz idéal.
Ces changements de température peuvent être quantifiés à l'aide de :
- La loi des gaz parfaits.
- L'équation hydrostatique des processus atmosphériques.
Le chauffage adiabatique se produit lorsque la pression d'un gaz augmente en raison du travail effectué sur lui par son environnement.
Le refroidissement adiabatique se produit lorsque la pression sur un système isolé adiabatiquement diminue. Cette diminution lui permet de s’étendre. À mesure que le volume augmente, la température et l’énergie interne diminuent.