En thermodynamique, un processus isobare est un changement d'état d'une certaine quantité de matière dans laquelle la pression reste constante . Ce qui change, c'est une ou plusieurs de ses variables d'état, telles que le volume et la température. Si de la chaleur est transférée au système, le travail est effectué et l’énergie interne du système change également.
Le processus isobare pour les gaz parfaits suit la loi de Charles. Selon cette loi, pour une masse fixe de gaz parfait à pression constante, le volume est directement proportionnel à la température en Kelvin.
Les processus isobares sont régis par la première loi de la thermodynamique. Dans ces processus, l'augmentation de l'enthalpie (ΔH) est égale à la chaleur transférée au système, et le travail effectué est P·ΔV. La relation entre l'énergie interne, le travail et la chaleur est exprimée par ΔU = Q−PΔV, avec Q = ΔH.
Définition d'un processus isobare
Un processus isobare est un processus dans lequel la pression reste constante tandis que le système subit d'autres changements. En termes plus techniques, on dit que la dérivée de la pression par rapport au temps est égale à zéro, c'est-à-dire :
dP/dt=0
Ce type de processus diffère des autres processus thermodynamiques, tels que les processus isochoriques (dans lesquels le volume est constant), les processus isothermes (dans lesquels la température est constante) et les processus adiabatiques (dans lesquels il n'y a pas de transfert de chaleur).
Même si la pression reste constante, d’autres propriétés du système, comme le volume et la température, peuvent changer. À mesure que le volume du système change, un travail est effectué, et ce travail est lié au changement de volume sous une pression constante.
Exemples de processus isobares
Pour mieux comprendre ce processus thermodynamique, il nous sera utile de voir quelques exemples.
-
Phase de détente d'un cylindre de moteur.
-
Eau bouillante dans un récipient ouvert.
-
Chauffage d'un globe dû aux effets du rayonnement solaire.
Chauffer l'air dans un ballon
Le changement de volume qu'un ballon subit lorsque les rayons du soleil le frappent est un exemple de processus isobare.
Au début de la matinée, il présente une certaine pression, volume et température. À mesure que l'air à l'intérieur se réchauffe, la pression augmente, mais elle ne varie pas en raison de l'augmentation de son volume.
Phase de détente du cylindre d'un moteur thermique
La détente de l'air dans un cylindre à piston mobile auquel est fournie de la chaleur est réalisée par un processus isobare.
Le volume augmentera proportionnellement à sa température et la pression restera constante. Ceci est conforme à la loi de Charles.
Eau bouillante dans un récipient ouvert
Un exemple quotidien de processus isobare se produit lorsque l’on fait bouillir de l’eau dans un récipient ouvert. En fournissant de l’énergie thermique à l’eau, celle-ci monte en température et se transforme en vapeur.
La vapeur obtenue a une température plus élevée et occupe un plus grand volume, cependant la pression reste constante. Dès le début, la pression est égale à la pression atmosphérique.
Loi des gaz parfaits et processus isobares
Pour bien comprendre les processus isobares, il est utile de considérer l' équation d'état des gaz parfaits , qui établit une relation entre la pression (P), le volume (V), la température (T) et la quantité de gaz (n) en moles, selon à l'équation :
P·V=n·R·T
Où R est la constante des gaz parfaits. Dans un processus isobare, la pression P est constante ; Cela implique que, dans des conditions de pression constante, le volume d’un gaz parfait est directement proportionnel à sa température.
Si la température d'un gaz augmente dans un processus isobare, son volume augmentera également proportionnellement, et si la température diminue, le volume diminuera.
Cette relation est une forme de la loi de Charles, qui est un cas particulier de la loi des gaz parfaits pour un processus isobare.
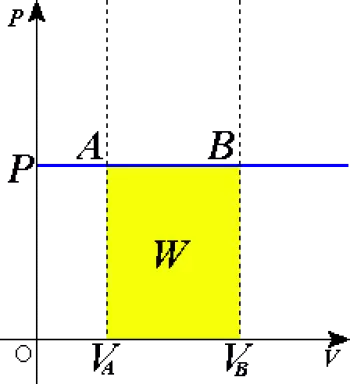
Travail effectué dans un processus isobare
 L’un des aspects les plus importants des processus isobares est le travail effectué par ou sur le système au cours du processus.
L’un des aspects les plus importants des processus isobares est le travail effectué par ou sur le système au cours du processus.
Dans un processus thermodynamique, le travail effectué par le système est défini comme :
W=∫P·dV
Dans un processus isobare, où la pression est constante, cette équation se simplifie comme suit :
W=P·ΔV
Où ΔV est la variation du volume du système. Si le volume augmente, le système agit sur son environnement, ce qui signifie que le gaz se dilate. Si le volume diminue, l'environnement agit sur le système en comprimant le gaz.
Ce travail effectué est étroitement lié à la variation de l'énergie interne et à la chaleur ajoutée ou retirée du système, selon la deuxième loi de la thermodynamique, qui énonce :
ΔU = Q−W
Où:
- ΔU est la variation de l’énergie interne du système.
- Q est la chaleur ajoutée au système.
- W est le travail effectué par le système.
Dans un processus isobare, la chaleur ajoutée au système modifie non seulement l'énergie interne du système, mais est également convertie en travail en raison du changement de volume. Cette caractéristique est différente d'un processus isochore, où toute la chaleur ajoutée est convertie en énergie interne, puisqu'aucun travail n'est effectué dans un système à volume constant.